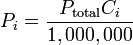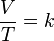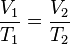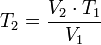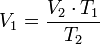Mayra Alejandra Velasco
Juliana Berrio
Jessica Parra
sábado, 14 de mayo de 2011
viernes, 13 de mayo de 2011
LEY DE GRAHAM (DIFUSIÓN)
La Ley de Graham, formulada en 1829 por Thomas Graham, establece que las velocidades de efusión de los gases son inversamente proporcionales a lasraíces cuadradas de sus respectivas densidades. La Ley de Graham, fORMULADA EN 1850 POR THOMAS ALBA GRAHAM - -
Siendo v las velocidades y δ las densidades.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
Los diferentes procesos que se realizan en las plantas, como lo son: la efusión, la ósmosis y la imbibición vegetal. se encuentran íntimamente ligados con el transporte de agua y de soluciones desde el punto de origen hasta el medio donde ésta es activada. Cada sustancia se difunde libremente de otras hasta que se difunden todas equitativamente. En la planta la velocidad de efusión depende del gradiente lo cual está determinado por la diferencia entre las concentraciones de las sustancias en las dos regiones y por la distancia que las separa.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia, se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
Velocidad de difusión de los gases
De los 4 estados de la materia, los gases presentan la mayor facilidad de efusión de sus respectivas moléculas, como ocurre en el aire, ya que sus moléculas tienen velocidades superiores. Las moléculas de diferentes clases tienen velocidades diferentes, a temperatura constante, dependiendo únicamente de la densidad
La difusión es el proceso por el cual una sustancia se esparce durante un proceso que se realiza uniformemente en el espacio que encierra el medio en que se encuentra. Por ejemplo: si se conectan dos tanques conteniendo el mismo gas a diferentes presiones, en corto tiempo la presión es igual en ambos tanques. También si se introduce una pequeña cantidad de gas A en un extremo de un tanque cerrado que contiene otro gas B, rápidamente el gas A se distribuirá uniformemente por todo el tanque.
La difusión es una consecuencia del movimiento continuo y elástico de las moléculas gaseosas. Gases diferentes tienen distintas velocidades de difusión. Para obtener información cuantitativa sobre las velocidades de difusión se han hecho muchas determinaciones. En una técnica el gas se deja pasar por orificios pequeños a un espacio totalmente vacío; la distribución en estas condiciones se llama efusión y la velocidad de las moléculas es igual que en la difusión. Los resultados son expresados por la ley de Graham. "La velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad."
En donde v1 y v2 son las velocidades de difusión de los gases que se comparan y d1 y d2 son las densidades. Las densidades se pueden relacionar con la masa y el volumen porque ( ); cuando M sea igual a la masa (peso) v molecular y v al volumen molecular, podemos establecer la siguiente relación entre las velocidades de difusión de dos gases y su peso molecular:
y como los volúmenes moleculares de los gases en condiciones iguales de temperatura y presión son idénticos, es decir V1 = V2, en la ecuación anterior sus raíces cuadradas se cancelan, quedando:
Es decir: la velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su peso molecular.
Ejemplo
¿Qué gas tiene mayor velocidad de difusión, el neón o el nitrógeno?
Respuesta
Primero se necesita conocer las densidades de los gases que intervienen. Como un mol de gas ocupa 22,4 L a T.P.E., sus densidades serán (peso molecular/volumen).
neón = 20/22,4 = 0,88 g/l
nitrógeno = 14/22,4 = 0.625 g/l
sea v1 = velocidad de difusión del nitrógeno y v2 = velocidad de difusión del neón.
Debido a que la velocidad de difusión es inversamente proporcional a las densidades, tendrá mayor velocidad de difusión el menos denso.
LEY DE DALTON
La ley de las presiones parciales fue formulada en el año 1803 por el físico, químico y matemático británico Jonh Dalton. Establece que la presión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si solo uno ocupase todo el volumen de la mezcla, sin cambiar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla de gases.
Donde representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
donde mi es la fracción molar del i-ésimo componente de la mezcla total de los m componentes. La relación matemática así obtenida es una forma de poder determinar analíticamente el volumen basado en la concentración de cualquier gas individualmente en la mezcla.
Donde la expresión: Ci es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.
Se puede hacer una definición más formal de la teoría mediante la aplicación de matemáticas, la presión de una mezcla de gases puede expresarse como una suma de presiones mediante:
 o igual
o igual 
Donde
 representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.
representan la presión parcial de cada componente en la mezcla. Se asume que los gases no tienen reacciones químicas entre ellos, el caso más ideal es con gases nobles.donde mi es la fracción molar del i-ésimo componente de la mezcla total de los m componentes. La relación matemática así obtenida es una forma de poder determinar analíticamente el volumen basado en la concentración de cualquier gas individualmente en la mezcla.
Donde la expresión: Ci es la concentración del i-ésimo componente de la mezcla expresado en unidades de ppm.
La ley de las presiones parciales de Dalton se expresa básicamente como que la presión total de una mezcla y esta es igual a la suma de las presiones parciales de los componentes de esta mezcla.
ECUACIÓN GENERAL DE UN ESTADO GAS IDEAL
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834.
Teoría cinética molecular
Esta teoría fue desarrollada por Ludwig Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.
Todo gas ideal está formado por N pequeñas partículas puntuales (átomos o moléculas).
Las moléculas gaseosas se mueven a altas velocidades, en forma recta y desordenada.
Un gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de este.
Los choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
No se tienen en cuenta las interacciones de atracción y repulsión molecular.
La energía cinética media de la translación de una molécula es directamente proporcional a la temperatura absoluta del gas.
En estas circunstancias, la ecuación de los gases se encuentra teóricamente:
donde κB es la constante de Boltzmann, donde N es el número de partículas.
LEY COMBINADA DE LOS GASES
La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas. Estudia el comportamiento de una determinada masa de gas si ninguna de esas magnitudes permanece constante.
Esta ley se emplea para todos aquellos gases ideales en los que el volumen, la presión y la temperatura no son constantes. Además la masa no varía. La fórmula de dicha ley se expresa: (V1 * P1) / T1 = (V2 * P2) / T2 Es decir, el volumen de la situación inicial por la presión original sobre la temperatura es igual a el volumen final por la nueva presión aplicada sobre la temperatura modificada.
La presión es una fuerza que se ejerce por la superficie del objeto y que mientras más pequeña sea ésta, mayor presión habráA partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).
LEY DE CHARLES
Es una de las leyes de los gases ideales. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa. En esta ley, Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se debe a que la "temperatura" está directamente relacionada con la energía cinética (debida al movimiento) de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Louis Joseph Gay-Lussac en 1802, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
La ley de Charles es una de las leyes más importantes acerca del comportamiento de los gases, y ha sido usada en muchas aplicaciones diferentes, desde para globos de aire caliente hasta en acuarios. Se expresa por la fórmula:
donde:
- V es el volumen
- T es la temperatura absoluta (es decir, medida en Kelvin)
- k es la constante de proporcionalidad.
Además puede expresarse como:
donde:
 = Volumen inicial
= Volumen inicial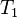 = Temperatura inicial
= Temperatura inicial
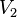 = Volumen final
= Volumen final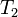 = Temperatura final
= Temperatura final
Despejando T1 se obtiene:
Despejando T2 se obtiene:
Despejando V1 es igual a:
Despejando V2 se obtiene:
LEY DE BOYLE
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión:
PV=K
donde es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante k para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
P1V1=P2V2
donde:
= Presión inicial
= Presión final
= Volumen inicial
= Volumen final
Para poder comprobar su teoría, Boyle hizo el siguiente experimento: Introdujo un gas en un cilindro con un émbolo y comprobó las distintas presiones al bajar el émbolo. A continuación hay una tabla que muestra algunos de los resultados que obtuvo:
Experimento de Boyle
× P (atm) V (L) P · V
0,5 60 30
1,0 30 30
1,5 20 30
2,0 15 30
2,5 12 30
3,0 10 30
Si se observan los datos de la tabla se puede comprobar que al disminuir el volumen, la presión , aumenta y que al multiplicar y se obtiene atm·L.
LEY DE GAY LUSSAC
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
P/T=K
(el cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
P1 /T1 = P2/T2
que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
Ejemplo:
Cierto volumen de un gas se encuentra a una presión de 970 mmHg cuando su temperatura es de 25.0°C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K= 298 K
Ahora sustituimos los datos en la ecuación:
P1 /T1 = P2/T2
| 970 mmHg | | 760 mmHg |
| ------------ | = | ------------ |
| 298 K | | T2 |
Si despejas T2 obtendrás que la nueva temperatura deberá ser 233.5 K o lo que es lo mismo -39.5 °C.
PROPIEDADES DE LOS GASES
GASES
En química un gas es el estado de la materia donde las sustancias no tienen ni forma ni volumen determinado, ellos lo adoptan según el recipiente que los contenga. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras
Aunque generalmente el gas suele utilizarse como sinónimo de vapor, esto solo ocurre con aquel gas que puede condensarse o presurizarse si se somete a una temperatura constante.
A diferencia de los sólidos que ostentan una forma bien definida y difícil de comprimir y de los líquidos que fluyen y fluyen, los gases se expanden libremente como bien decíamos más arriba y su densidad es muchísimo menor a la de los líquidos y sólidos.
Aunque generalmente el gas suele utilizarse como sinónimo de vapor, esto solo ocurre con aquel gas que puede condensarse o presurizarse si se somete a una temperatura constante.
A diferencia de los sólidos que ostentan una forma bien definida y difícil de comprimir y de los líquidos que fluyen y fluyen, los gases se expanden libremente como bien decíamos más arriba y su densidad es muchísimo menor a la de los líquidos y sólidos.
Suscribirse a:
Entradas (Atom)