Es una de las leyes de los gases ideales. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenido a una presión constante, mediante una constante de proporcionalidad directa. En esta ley, Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye. Esto se debe a que la "temperatura" está directamente relacionada con la energía cinética (debida al movimiento) de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Louis Joseph Gay-Lussac en 1802, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles. La relación había sido anticipada anteriormente en los trabajos de Guillaume Amontons en 1702.
La ley de Charles es una de las leyes más importantes acerca del comportamiento de los gases, y ha sido usada en muchas aplicaciones diferentes, desde para globos de aire caliente hasta en acuarios. Se expresa por la fórmula:
donde:
- V es el volumen
- T es la temperatura absoluta (es decir, medida en Kelvin)
- k es la constante de proporcionalidad.
Además puede expresarse como:
donde:
 = Volumen inicial
= Volumen inicial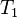 = Temperatura inicial
= Temperatura inicial
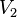 = Volumen final
= Volumen final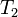 = Temperatura final
= Temperatura final
Despejando T1 se obtiene:
Despejando T2 se obtiene:
Despejando V1 es igual a:
Despejando V2 se obtiene:
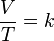
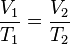

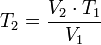
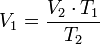

No hay comentarios:
Publicar un comentario